Sicherheitsmitteilung für Medizinprodukte
Philips Respironics Geräte für die Schlaf- und Atemwegstherapie
FSN 2021-05-A & FSN 2021-06-A
Seit Oktober 2023 hat Philips Respironics mit der Reparatur von Trilogy 100/200-Geräten durch von Philips zugelassene Reparaturzentren in mehreren Ländern begonnen.
Kunden haben weiterhin die Wahl zwischen der Reparatur ihrer Geräte, dem Geräterückkauf in Form einer Verkaufsgutschrift, Trilogy Evo-Upgrades und einem Trilogy Evo-Leihprogramm. Unser Ziel ist es, mit Kunden zusammenzuarbeiten, um die Behebung so schnell wie möglich abzuschließen und Patienten mit betroffenen Trilogy 100/200-Geräten zu versorgen.Bei weiteren Fragen wenden Sie sich bitte an Ihren Philips Respironics Account Manager.
Nachfolgend finden Sie eine Aktualisierung zum Status unseres Remedierungsprogramms für betroffene CPAP-, BiPAP- und mechanische Beatmungsgeräte zum 31. Oktober 2024. Neben der Anzahl der gelieferten Ersatzgeräte geben wir auch einen Überblick über die Anzahl der Geräte, die finanziell kompensiert werden und die Anzahl der Geräte, die von Leistungserbringern nicht mehr zurückverfolgt werden können.
1,037,268
Anzahl der produzierten Reparatursets und Ersatzgeräte für Westeuropa
100,641
Anzahl der reparierten Geräte, die an Leistungserbringer in Deutschland geliefert wurden
120,227
Finanzieller Ausgleich1 von Geräten an die Anbieter von Leistungserbringern
64,254
Nicht verfolgbare Geräte2
1. Einige ältere System One Schlafapnoe-Geräte werden nicht mehr von Philips hergestellt und verkauft. In vielen Fällen sind diese Geräte älter als fünf Jahre. In Absprache mit den Leistungserbringern hat sich Philips auf eine Lösung für diese Patienten geeinigt. Leistungserbringer erhalten für einen Teil der gebrauchten Geräte Ersatz- oder Reparaturgeräte. Darüber hinaus bietet Philips für einige dieser System One-Geräte eine finanzielle Vergütung an, damit Leistungserbringer ein weiteres Gerät für den Patienten kaufen können.
2. Die Leistungserbringer haben eine Reihe von Geräten registriert, die nicht mehr verwendet werden oder nicht mehr zurückverfolgt werden können. Die Leistungserbringer haben sich bemüht, alle Geräte und Patienten zurückzuverfolgen. Wir gehen davon aus, dass diese "nicht mehr rückverfolgbaren Geräte" nicht mehr verwendet werden.
You are about to visit a Philips global content page
Continue
Informationen für Patienten
Die Patientensicherheit hat für uns oberste Priorität. Wir sind bestrebt, die Remedierung für alle betroffenen Patienten abzuschließen, um sicherzustellen, dass Sie eine sichere und wirksame Therapie erhalten.
Wir wissen, dass jede Situation individuell ist, abhängig von Ihrem betroffenen Gerät und Ihrer persönlichen Situation. Wenn Sie nach Erhalt Ihres Ersatzgeräts Fragen zum Remedierungsprozess haben oder zusätzliche Unterstützung benötigen, wenden Sie sich bitte an Ihren häuslichen Pflegedienst oder Ihren Arzt.

Wir haben einen Leitfaden erstellt, der jeden Schritt des Korrekturprozesses erläutert So können Sie nachvollziehen, wie wir mit der Sicherheitsmitteilung umgehen und was Sie erwarten dürfen.
Letzte Updates
Philips gibt Update zum Respironics-Sicherheitsmitteilung
06. Oktober 2023
Antwort von Philips auf die jüngsten Medienartikel im Zusammenhang mit der freiwilligen Sicherheitsmitteilung von Philips Respironics
27. September 2023
Die neuesten Ergebnisse und Schlussfolgerungen für Schlaftherapiegeräte vom Juli 2023 in Bezug auf die Auswirkungen einer Ozonreinigung zeigen keine nennenswerten Gesundheitsschäden bei Patienten
Philips Respironics hat auch die Analysen für die Schlaftherapiegeräte System One und DreamStation Go abgeschlossen und festgestellt, dass die flüchtigen organischen Verbindungen (VOCs) und die Partikelemissionen (PM) im Zusammenhang mit einer Zersetzung des Schaums innerhalb der geltenden Sicherheitsgrenzen liegen. Zusätzliche visuelle Untersuchungen wurden durchgeführt und bestätigen eine geringe Prävalenz einer signifikanten Schaumzersetzung.
You are about to visit a Philips global content page
Continue
Erläuterung der Maßnahmen zur Garantie der Sicherheit Ihres CPAP- oder BiPAP-Ersatzgeräts
Wir bemühen uns, Ihnen so schnell wie möglich ein Ersatzgerät zur Verfügung zu stellen. Nachfolgend möchten wir Sie über die Maßnahmen informieren, welche wir ergreifen, um sicherzustellen, dass die Verwendung Ihres DreamStation Ersatzgeräts der ersten Generation sicher ist.


Ozonreiniger als auch Reinigungsprodukte mit UV-Licht sind gegenwärtig nicht als Reinigungsmethoden für Schlafapnoe-Geräte und -Masken zugelassen und dürfen nicht verwendet werden.
Kontinuierliche Unterstützung

Sicherheitsmitteilung lesen und betroffenes Gerät registrieren

Mehr über Ihr Ersatzgerät erfahren
Fragen und Antworten
Die nachfolgend aufgeführten Produkte sind von der Sicherheitsmitteilung betroffen:
CPAP- und BiLevel PAP-Geräte
Alle betroffenen Geräte, die vor dem 26. April 2021 hergestellt wurden, alle Geräte-Seriennummern
Kontinuierliches Beatmungsgerät, minimale Atmungsunterstützung, Nutzung durch eine Einrichtung
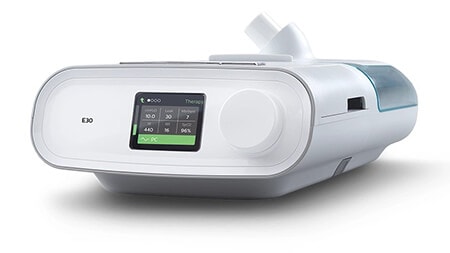
E30
(Erklärung zur Notfallzulassung)

DreamStation ASV
Auch DreamStation BiPAP autoSVgenannt

DreamStation ST, AVAPS
Auch DreamStation BiPAP AVAPS, DreamStation BiPAP S/T genannt

System One ASV4
Auch System One BiPAP autoSV, System One BiPAP autoSV Advancedgenannt

S/T C-Serie, AVAPS
Auch System One BiPAP AVAPS (C-Serie), System One BiPAP S/T (C-Serie) genannt

OmniLab Advanced Plus
Schlaflabor-Titriergeräte

BiPAP Synchrony II
Legacy BiPAP

BiPAP ASV II & III
Legacy BiPAP
Kontinuierliches Beatmungsgerät, minimale Atmungsunterstützung, Nutzung durch eine Einrichtung

A-Serie BiPAP Hybrid A30
Auch BiPAP Hybrid A30Beatmungsgerät (A-Serie)genannt
(in den USA nicht erhältlich)

A-Serie BiPAP V30 Auto Beatmungsgerät
Auch BiPAP V30 AutoBeatmungsgerät (A-Serie) genannt
Kontinuierliches Beatmungsgerät, nicht lebenserhaltend

A-Serie BiPAP A40
Auch BiPAP A40Beatmungsgerät(A-Serie)genannt
(in den USA nicht erhältlich)

A-Serie BiPAP A30
Auch BiPAP A30Beatmungsgerät (A-Serie) genannt
(in den USA nicht erhältlich)
Wenn Ihr Gerät betroffen ist…
Welche Produkte sind nicht betroffen und warum?
Produkte, die nicht betroffen sind, können andere schalldämmende Schaumstoffe enthalten, da im Laufe der Zeit neue Materialien und Technologien verfügbar sind. Außerdem kann der schalldämmende Schaumstoff in nicht betroffenen Geräten aufgrund der Gerätekonstruktion an einer anderen Position angebracht sein.